UNSERE FORSCHUNG
Neva Caliskans Forschungsgruppe untersucht die Rolle von RNA-Molekülen bei nicht-kanonischen Translationsereignissen, die das Zusammenspiel zwischen Wirt und Pathogen beeinflussen können. Ihr Ziel ist es, therapeutische RNA-Protein-Komplexe als neue Ansatzpunkte im Kampf gegen Infektionen zu beleuchten.
In Viren oder zellulären Genen verschlüsselte RNAs können während der Translation auf alternative Weise gelesen werden, was als Rekodierung bezeichnet wird. Es ist jedoch unklar, wie genau die Rekodierung durch den Wirt reguliert wird. Ein genaues Verständnis der Rekodierung und ihrer Regulation kann daher der Schlüssel zur Entwicklung neuer RNA-basierter Therapien im Kampf gegen Infektionen sein.
In diesem Zusammenhang untersucht Neva Caliskans Gruppe die Funktion und Dynamik von RNA-Molekülen und wie sie mit Faktoren mit Trans-Wirkung zusammenspielen. Die Wissenschaftler arbeiten dafür mit Viren wie Corona- und Retroviren, bei denen bekannt ist, dass sie für ihre Replikation auf Rekodierung angewiesen sind. Gemeinsam entwickeln sie Methoden, um RNA-Komplexe und Translation in bisher ungekannter Detailtreue zu erforschen.
Die Gruppe nutzt ein stark interdisziplinäres Toolset, etwa RNA-Antisense-Reinigung und Massenspektrometrie, um RNA-Interaktionspartner zu erkennen und zelluläre Assays um molekulare Details zu untersuchen. Assays für Einzelmoleküle oder Molekülgruppen wie optische Pinzetten spielen für die Erforschung von RNA-Komplexen eine wichtige Rolle. Um die Entwicklung RNA-basierter Therapien voranzubringen, wollen die Wissenschaftlerinnen und Wissenschaftler verstehen, wie RNA-Strukturelemente mit anderen Faktoren in der Zelle zusammenwirken, um die Weise zu regulieren, wie mRNA von den Ribosomen gelesen wird.
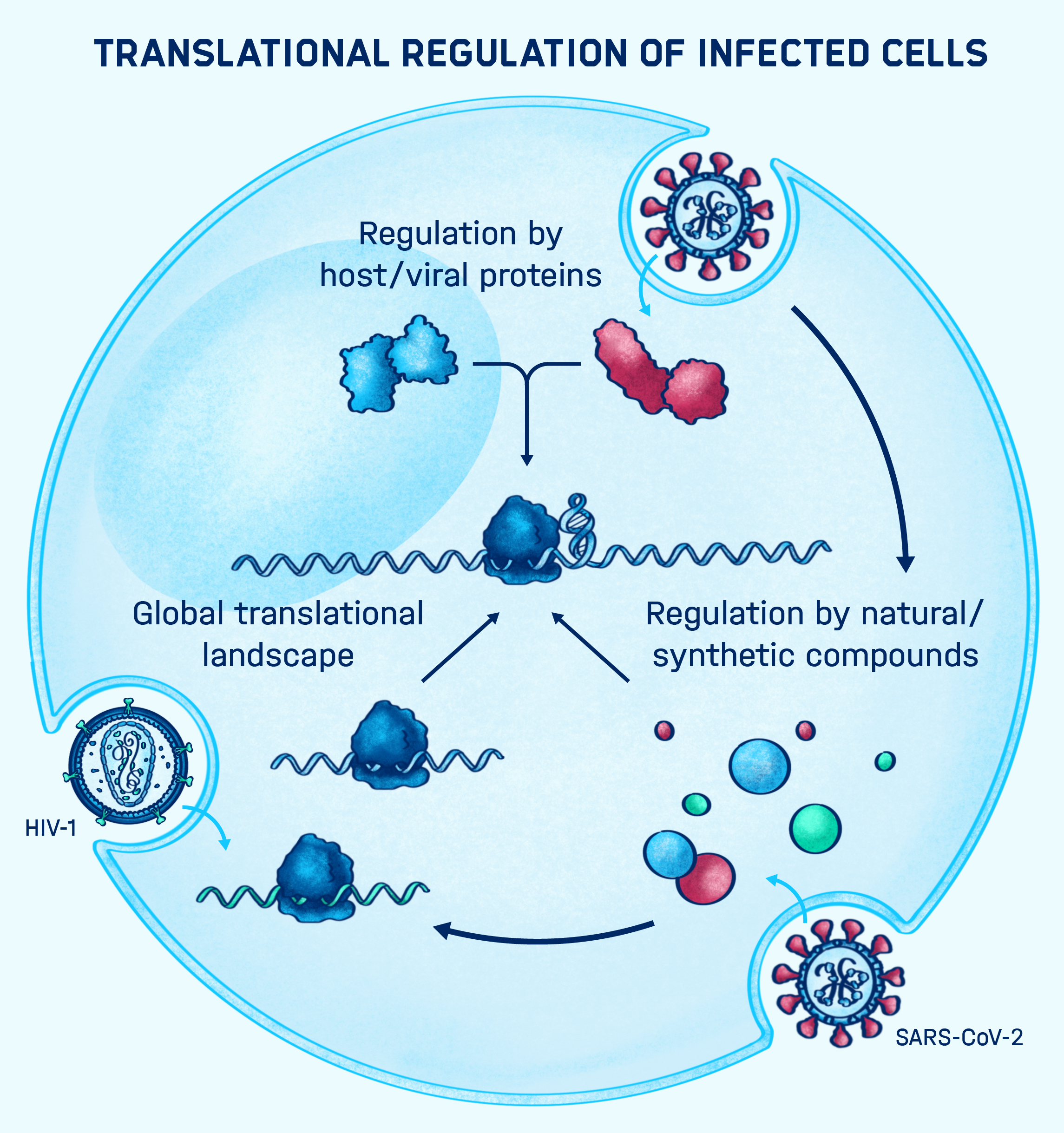

EIN BLICK IN DIE BLACK BOX: WIE RELEVANT IST DIE REKODIERUNG IN EUKARYOTISCHEN ZELLEN?
Veränderungen in der Umwelt, Hunger und möglicherweise Infektionen haben das Potenzial, die Entschlüsselungsregeln zu verändern und dadurch das zelluläre Proteom auf unerwartete Weise zu beeinflussen. Es ist jedoch meist unklar, inwieweit nicht-standardisierte Translationsereignisse von menschlichen Zellen, z.B. bei Infektionen, genutzt werden.
Wir setzen modernste RNA-Analytik wie Ribosomen-Profiling und Tiefensequenzierung ein, um die Dynamik nicht standardisierter Translationsregime und die potenzielle Rolle zellulärer Faktoren in diesem Prozess zu verstehen. Unser letztendliches Ziel ist es, das Zusammenspiel zwischen der Genexpression des Wirts und des Pathogens besser zu verstehen.
WIE VERMITTELN VIRUS- UND WIRTSFAKTOREN REKODIERUNGSEREIGNISSE?
Es wird erwartet, dass während der Infektion virale RNA-Moleküle mit dem Wirt und viralen Proteinen interagieren, was für den viralen Replikationszyklus entscheidend sein könnte. Jüngste Beispiele bei Kardioviren (EMCV und TMEV) deuten darauf hin, dass Frameshifting direkt durch virale 2A-Protein-RNA-Interaktionen vermittelt werden kann. Dadurch wird sichergestellt, dass das alternative Frameshifting-Produkt zum richtigen Zeitpunkt während der Infektion hergestellt wird. Darauf aufbauend untersucht meine Gruppe, wie virale Proteine während der Translation dynamisch mit strukturierten RNAs und dem Translationsapparat des Wirts interagieren.
Es ist immens wichtig, ein besseres mechanistisches Verständnis darüber zu erlangen, wie Transfaktoren die Rekodierungsereignisse steuern und die mechanischen Eigenschaften der RNA verändern, da die Modulation der RNA eine wirksame antivirale Strategie darstellt.
Unser Team hat in jüngster Zeit mehrere virale RNA-Interaktionspartner identifiziert, von denen wir gezeigt haben, dass sie die Synthese des SARS-CoV-2-Polyproteins stören. Wir arbeiten derzeit auch an der Identifizierung kleiner Moleküle, die spezifisch mit SARS-CoV-2-RNA-Elementen interagieren können, was wir als nächstes für das CoV-2-RNA-Targeting nutzen wollen.

WIE RNA-KONFORMATIONSDYNAMIK UND INTERAKTIONEN ALTERNATIVE TRANSLATIONSEREIGNISSE ANTREIBEN
RNAs können in verschiedenen Formen existieren und mit anderen regulatorischen Elementen wie ncRNAs, kleinen Molekülen und Proteinen interagieren, um die Bedeutung der in der Primärsequenz der mRNA kodierten Botschaft zu verändern. Wie RNA-Strukturen und regulatorische Elemente alternative Translationsereignisse steuern, ist derzeit noch nicht vollständig verstanden. Eine Schlüsselfrage, mit der wir uns befassen, lautet: "Inwieweit definiert die Stärke der RNA-Basenpaarungs-Interaktionen und die Konformationsdynamik der Struktur die Neigung der Ribosomen, sich in ein alternatives Leseraster zu bewegen?" Mit Hilfe modernster Einzelmolekül- und Ensembleanalyse-Tools untersuchen wir, wie trans-wirkende Faktoren die RNA-Struktur verändern. Die von uns entwickelten Werkzeuge dienen als Einstiegspunkt für die Entwicklung potenter und spezifischer Modulatoren des Frameshifting.
Publikationen
2024
Translation Inhibition Mediated by Interferon-Stimulated Genes during Viral Infections
Smart A, Gilmer O, Caliskan N (2024)
Viruses 16 (7)
2023
Cis-mediated interactions of the SARS-CoV-2 frameshift RNA alter its conformations and affect function
Pekarek L, Zimmer MM, Gribling-Burrer AS, Buck S, Smyth RP, Caliskan N (2023)
Nucleic Acids Research 51 (2): 728–743
SND1 binds SARS-CoV-2 negative-sense RNA and promotes viral RNA synthesis through NSP9
Schmidt N, Ganskih S, Wei Y, Gabel A, Zielinski S, Keshishian H, Lareau CA, Zimmermann L, Makroczyova J, Pearce C, …, Erhard F, Munschauer M (2023)
Cell 186 (22): 4834-4850.e23
Mouse Liver-Expressed Shiftless Is an Evolutionarily Conserved Antiviral Effector Restricting Human and Murine Hepaciviruses
Zhang Y, Kinast V, Sheldon J, Frericks N, Todt D, Zimmer M, Caliskan N, Brown RJP, Steinmann E, Pietschmann T (2023)
Microbiology Spectrum 11 (4): e0128423
2022
Short- and long-range interactions in the HIV-1 5' UTR regulate genome dimerization and packaging
Ye L, Gribling-Burrer AS, Bohn P, Kibe A, Börtlein C, Ambi UB, Ahmad S, Olguin-Nava M, Smith M, Caliskan N, von Kleist M, Smyth RP (2022)
Nature Structural & Molecular Biology 29 (4): 306-319
Spacer prioritization in CRISPR-Cas9 immunity is enabled by the leader RNA
Liao C, Sharma S, Svensson SL, Kibe A, Weinberg Z, Alkhnbashi OS, Bischler T, Backofen R, Caliskan N, Sharma CM, Beisel CL (2022)
Nature Microbiology 7 (4): 530-541
Editorial: mRNA Translational Control as a Mechanism of Post-transcriptional Gene Regulation
Kiss DL, Vasudevan D, Ho CK, Caliskan N (2022)
Frontiers in Molecular Biosciences 9: 947516
POTATO: Automated pipeline for batch analysis of optical tweezers data
Buck S, Pekarek L, Caliskan N (2022)
Biophysical Journal 121 (15): 2830-2839
Insights from structural studies of the cardiovirus 2A protein
Caliskan N, Hill CH (2022)
Bioscience Reports 42 (1): BSR20210406
Optical Tweezers to Study RNA-Protein Interactions in Translation Regulation
Pekarek L, Buck S, Caliskan N (2022)
Journal of Visualized Experiments (180)
Thinking Outside the Frame: Impacting Genomes Capacity by Programmed Ribosomal Frameshifting
Riegger RJ, Caliskan N (2022)
Frontiers in Molecular Biosciences 9: 842261
2021
Structural and molecular basis for Cardiovirus 2A protein as a viral gene expression switch
Hill CH, Pekarek L, Napthine S, Kibe A, Firth AE, Graham SC, Caliskan N, Brierley I (2021)
Nature Communications 12 (1): 7166
Investigating molecular mechanisms of 2A-stimulated ribosomal pausing and frameshifting in Theilovirus
Hill CH, Cook GM, Napthine S, Kibe A, Brown K, Caliskan N, Firth AE, Graham SC, Brierley I (2021)
Nucleic Acids Research 49 (20): 11938-11958
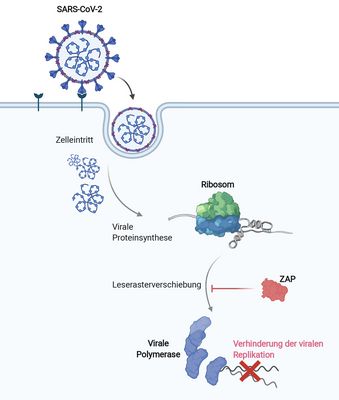
The short isoform of the host antiviral protein ZAP acts as an inhibitor of SARS-CoV-2 programmed ribosomal frameshifting
Zimmer MM, Kibe A, Rand U, Pekarek L, Ye L, Buck S, Smyth RP, Cicin-Sain L, Caliskan N (2021)
Nature Communications 12 (1): 7193
2020
The SARS-CoV-2 RNA-protein interactome in infected human cells
Schmidt N, Lareau CA, Keshishian H, Ganskih S, Schneider C, Hennig T, Melanson R, Werner S, Wei Y, Zimmer M, …, Bodem J, Munschauer M (2020)
Nature Microbiology 6 (3): 339-353
2019
Thermodynamic control of -1 programmed ribosomal frameshifting
Bock LV, Caliskan N, Korniy N, Peske F, Rodnina MV, Grubmüller H (2019)
Nature Communications 10: 4598
2018
Small synthetic molecule-stabilized RNA pseudoknot as an activator for -1 ribosomal frameshifting
Matsumoto S, Caliskan N, Rodnina MV, Murata A, Nakatani K (2018)
Nucleic Acids Research 46 (16): 8079-8089
2017
Conditional Switch between Frameshifting Regimes upon Translation of dnaX mRNA
Caliskan N, Wohlgemuth I, Korniy N, Pearson M, Peske F, Rodnina MV (2017)
Molecular Cell 66 (4): 558-567.e4
Aktuelles
Hier finden Sie alle aktuellen Neuigkeiten aus der Biochemie.

Team Fotos
- All
- Team
- Lab Outing
- Lab






Im Fokus

HOFFNUNGSSCHIMMER IN DER PANDEMIE
Protein ZAP hemmt Vermehrung von SARS-CoV-2 um das 20-Fache / Studie erschienen in "Nature Communications"
Wissenschaftler:innen aus Caliskans Arbeitsgruppe und anderen Laboren am HIRI Würzburg und HZI Braunschweig weisen erstmals nach, wie ZAP, ein Protein der menschlichen Immunabwehr, den Vermehrungsmechanismus des Coronavirus SARS-CoV-2 hemmt und die Viruslast um das 20-Fache reduzieren kann. Die Erkenntnisse wurden im Fachjournal Nature Communications veröffentlicht und könnten dazu beitragen, antivirale Mittel im Kampf gegen die Pandemie zu entwickeln.

THE POTATO TOOL: DATA ANALYSIS MADE EASY
Practical Optical Tweezers Analysis Tool
Sogenannte optische Pinzetten (engl. optical tweezers) emöglichen die Untersuchung von intra- und intermolekularen Wechselwirkungen, die komplexe biologische Prozesse steuern. Jüngste Entwicklungen haben die Datenerfassung erleichtert, doch deren Analyse bleibt schwierig. Um eine effizientere Datenanalyse zu ermöglichen, haben wir das Python-basierte Analyse-Tool POTATO (engl. Practical Optical Tweezers Analysis Tool) entwickelt. POTATO verwendet vorgegebene Parameter, um automatisch Rohdaten zu verarbeiten. Unsere Forschungsergebnisse wurden in der Fachzeitschrift Biophysical Journal vorgestellt.
Team
Das ist unser super tolles Team!

Prof. Dr. Neva Caliskan
Lehrstuhlinhaberin
Pd. Dr. Laura Manelyte
Scientific Staff
Dr. Alexandria Smart
Scientific Staff
PHD Saurav Malik
Scientific Staff
Kristin Hergert
Technical Staff